Potenziale di un elettrodo e prodotto di solubilità
Calcolo del potenziale di un elettrodo dal prodotto di solubilità
Calcolare il potenziale di un elettrodo di argento immerso in una soluzione satura di solfuro di argento. Si sappia che E°Ag+/Ag = 0,799 V e che il prodotto di solubilità di Ag2S è 1,5 · 10-49.
Svolgimento dell'esercizio
L'esercizio propone il calcolo del potenziale di un elettrodo di argento immerso in una soluzione satura di solfuro di argento.
Il solfuro di argento (Ag2S) è un sale poco solubile che si dissocia in acqua nel seguente modo:
Ag2S → 2 Ag+ + S2−
La semireazione scritta nel senso della riduzione tra Ag+ e Ag è la seguente:
Ag+ + e− → Ag
il cui potenziale di riduzione vale:
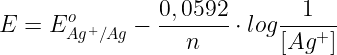
in cui:
- E°Ag+/Ag = 0,799 V;
- n = 1 (infatti nella semireazione di riduzione è scambiato un solo elettrone).
Rimane da determinare il valore della concentrazione molare degli ioni Ag+, dato che possiamo ricavare dal prodotto di solubilità.
Come detto in precedenza il solfuro di argento (Ag2S) è un sale poco solubile che si dissocia in acqua nel seguente modo:
Ag2S → 2 Ag+ + S2−
Il prodotto di solubilità di Ag2S può essere calcolato nel seguente modo:
Kps = [Ag+]2 · [S2−]
Se indichiamo con la lettera s la solubilità in mol/L di Ag2S, si ha che:
[Ag+] = 2 · s
[S2−] = s
Sostituendo questi dati in:
Kps = [Ag+]2 · [S2−]
risulta che:
Kps = (2 · s)2 · s = 4 · s2 · s = 4 · s3
Da cui:
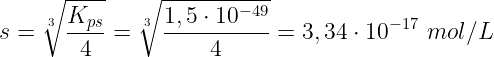
Ricordando che:
[Ag+] = 2 · s
si ha:
[Ag+] = 2 · 3,34 · 10-17 = 6,68 · 10-17 mol/L
Sostituendo tale dato nell'equazione:
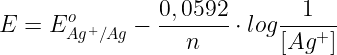
e ricordando che:
- E°Ag+/Ag = 0,799 V
- n = 1
si ha che:
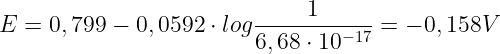
In conclusione, il potenziale di un elettrodo di argento immerso in una soluzione satura di solfuro di argento è di -0,158 V.
Link correlati:
Esercizi sulle pile e sull'equazione di Nernst
Esercizio sul calcolo del prodotto di solubilità del solfuro di argento dal potenziale d'elettrodo
Esercizio sul calcolo della fem di una pila e della Keq
Studia con noi